Die - moderne
- einfache
- sichere
- moderne
Lösung für klinische Studien
Ein validiertes System für klinische Studien mit Fokus auf Nutzerfreundlichkeit, Kollaboration und Datenstandards. Vollständig GCP- und DSGVO-konform.
Professionell im Detail
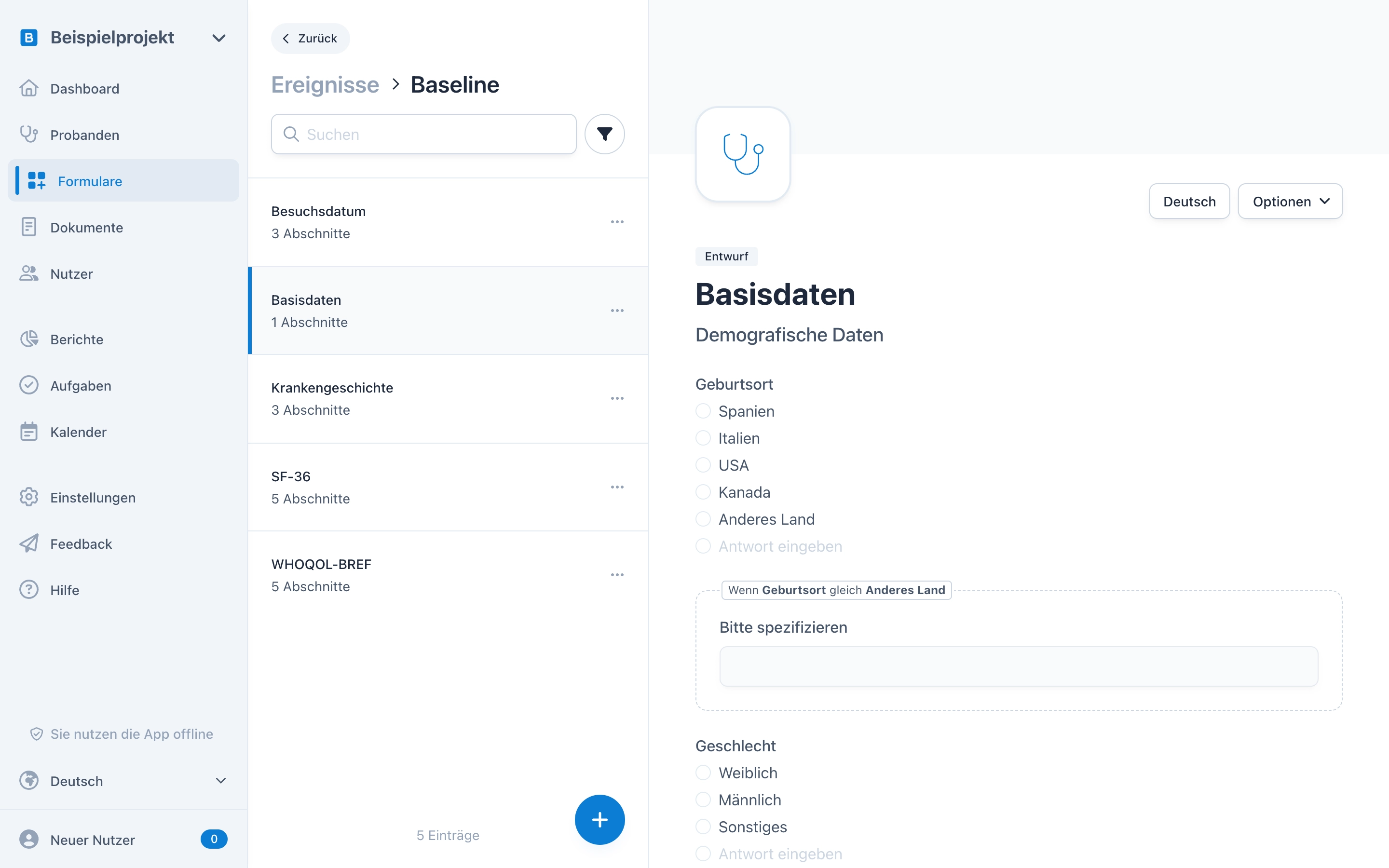
Erstellen Sie professionelle, mehrsprachige eCRFs — inklusive Echtzeitvalidierungen, Verzweigungslogiken und wiederholbaren Elementen. Laden Sie Personen mit einem Rollen- und Rechtesystem ein. Führen sie multizentrische Studien durch und verfolgen Sie alle Änderungen in einem Audit-Trail.
Mobil auf dem Tablet
Erheben Sie Daten am Computer oder mobil auf Tablets, lassen Sie versionierte Einwilligungserklärungen digital unterschreiben und greifen Sie flexibel von überall auf Ihre Studien zu.
Flexibel für Patienten
Versenden Sie ePROs oder nutzen Sie unsere Patienten-App mit Push-Benachrichtigungen für automatische Erinnerungen.


Tagebuch beantworten
Jetzt
Liebe Patientin, dein nächstes Formular ist bereit. Tippe hier.

Unsere Cloud: Ihre sichere Plattform für klinische Studien.
Entwickelt in Deutschland, betrieben in der Telekom Cloud. Unverbindliche Demo vereinbaren.
Branchen und Anwendungsgebiete
Vom Patiententagebuch bis hin zur klinischen Studie
OpenEDC ist für jede Branche und jedes Forschungsvorhaben die ideale Lösung. Vom Patiententagebuch, über klinikinterne Outcome-Forschung bis hin zu multizentrischen klinischen Studien. Durch den modularen Ansatz kann die Lösung individuell angepasst werden.

Pharma und Biotechnologie
OpenEDC unterstützt pharmazeutische und Biotech-Unternehmen bei der Durchführung regulierter klinischer Studien mit einem vollständig validierten System. Erfüllt alle Anforderungen nach ICH-GCP, FDA 21 CFR Part 11 und EU-GMP Annex 11 für maximale Datenintegrität und Compliance.
Medizintechnik- und ‑produktehersteller
Medizintechnikhersteller können mit OpenEDC klinische Prüfungen und Post-Market-Surveillance effizient durchführen. Das System erfüllt alle regulatorischen Vorgaben der MDR und bietet revisionssichere Dokumentation, elektronische Signaturen und einen lückenlosen Audit-Trail.
Clinical Research Organizations (CROs)
CROs profitieren von einem flexiblen, GCP-konformen EDC-System für multizentrische Studien. OpenEDC bietet Rollen- und Rechtesysteme, Source Data Verification, Query Management und vollständige Validierung nach GAMP 5 – für höchste Qualität in jedem Projekt.
Kliniken und Institute
Universitätskliniken und Forschungseinrichtungen können mit OpenEDC Patiententagebücher, Register, epidemiologische Studien und Outcome-Forschung realisieren. Das System ermöglicht multizentrische Projekte, ein globales Nutzermanagement und erfüllt alle Anforderungen an den Datenschutz.
Funktionen
Eine Vielzahl an Möglichkeiten
OpenEDC bietet Ihnen alle notwendigen Funktionen zum schnellen und einfachen Umsetzen Ihres Forschungsprojektes.
Eine modulare Plattform
Von einfacher Datenerhebung, über eConsent, bis hin zu vollständig dezentralen klinischen Studien: OpenEDC bietet alles, was moderne Forschung heute benötigt. Funktionen können beliebig kombiniert werden, um jede Studie effizient und sicher durchzuführen. Klicken Sie auf eine Funktion, um mehr zu erfahren.
 OpenEDC
OpenEDC Einfache Formularerstellung
OpenEDC bietet einen interaktiven, einfach zu verstehenden Formulareditor. Tippen Sie Fragen und Antwortoptionen auf natürliche Weise ein. Sehen Sie jederzeit, wie das fertige Formular aussieht. Erstellen Sie mehrsprachige Formulare mit Echtzeit-Validierung, Verzweigungslogiken, Datei-Uploads und vieles mehr.
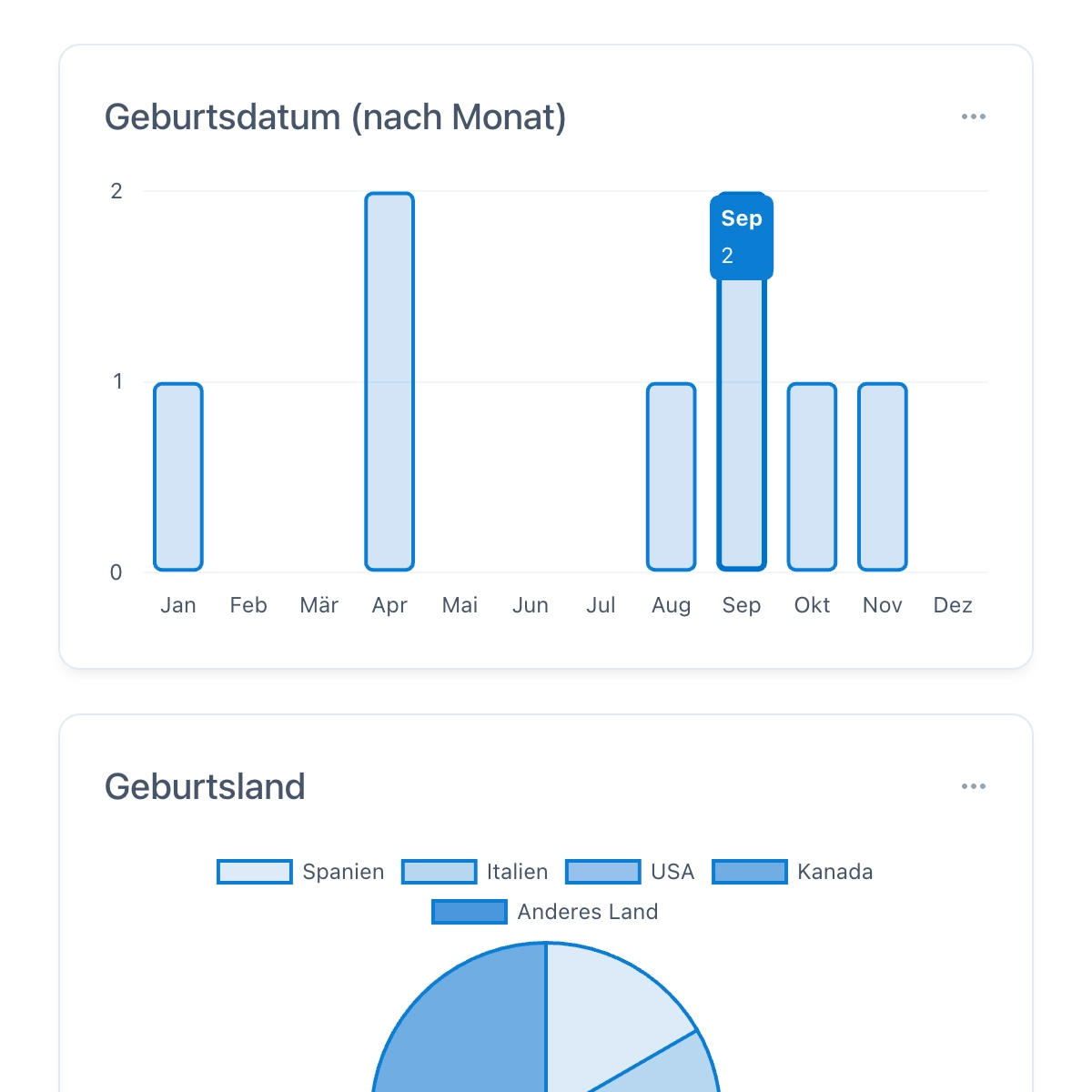
Berichte und Analysen
Mit OpenEDC lassen sich leistungsstarke, hochinteraktive Berichte erstellen. Filtern Sie Daten einfach mit einem Klick und kombinieren Sie mehrere Filter, bis Sie Ihren gewünschten Ausschnitt sehen. Diesen Ausschnitt können Sie dann ganz einfach exportieren, mit anderen Tools weiter auswerten oder teilen.
FDA-, GCP- und EU-konform
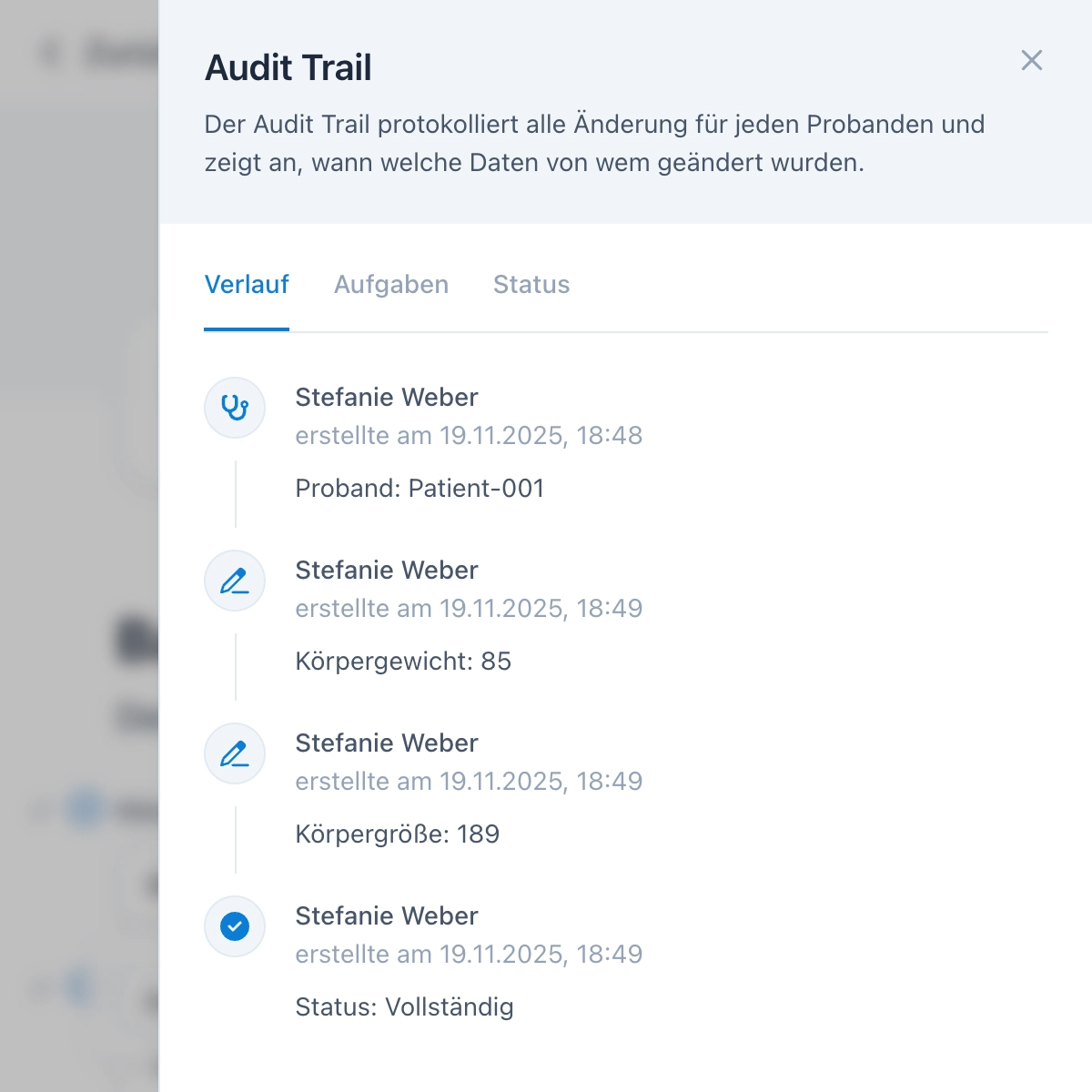
OpenEDC hält alle gesetzlichen Vorgaben nach FDA 21 CFR Part 11, ICH-GCP und EU-GMP Annex 11 ein. Zum Beispiel protokolliert der Audit Trail alle Änderungen mit Zeitstempel, elektronische Signaturen erfordern eine erneute Passworteingabe und das Rollen- und Rechtesystem erlaubt selektive Zugriffsbeschränkungen.
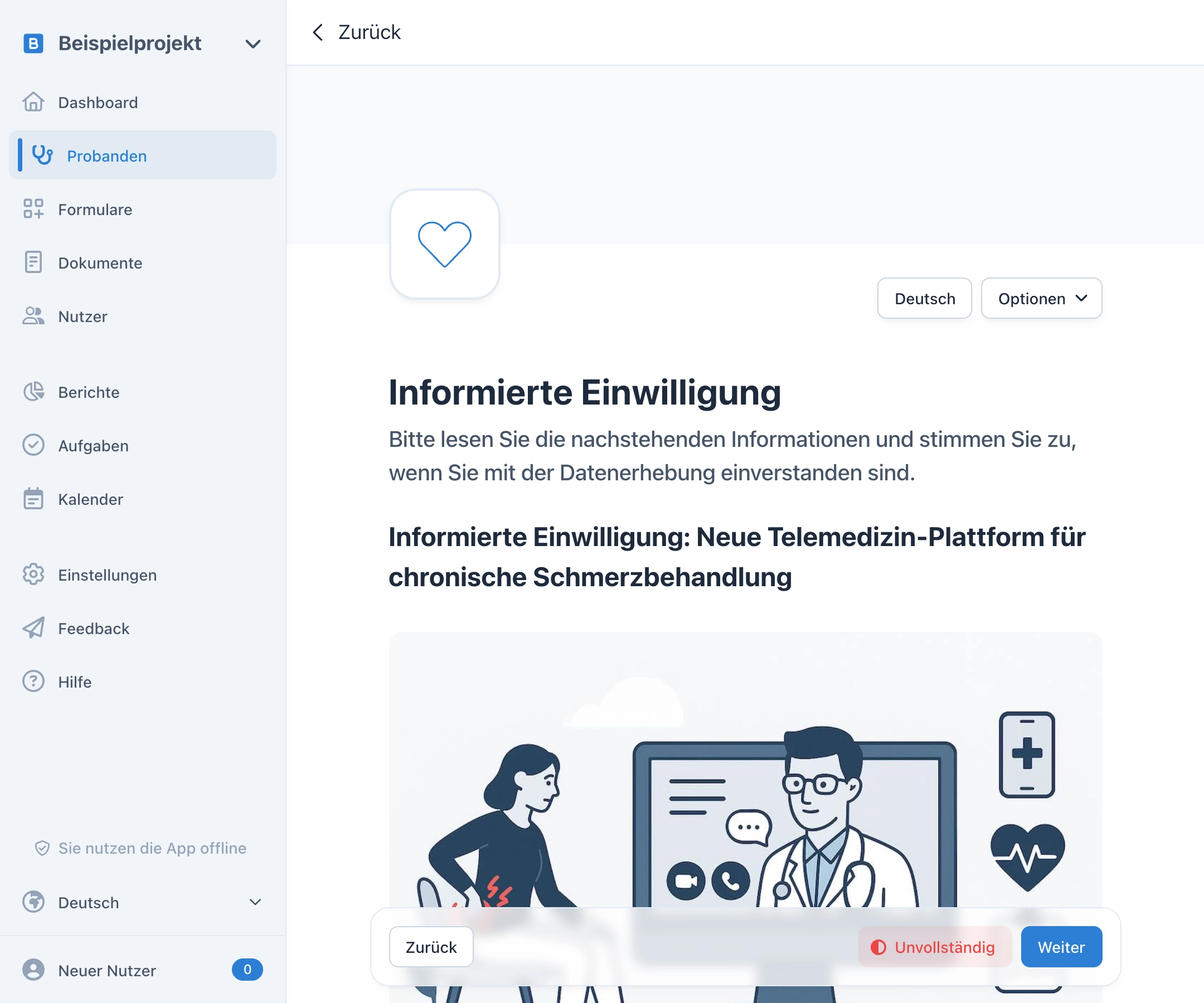
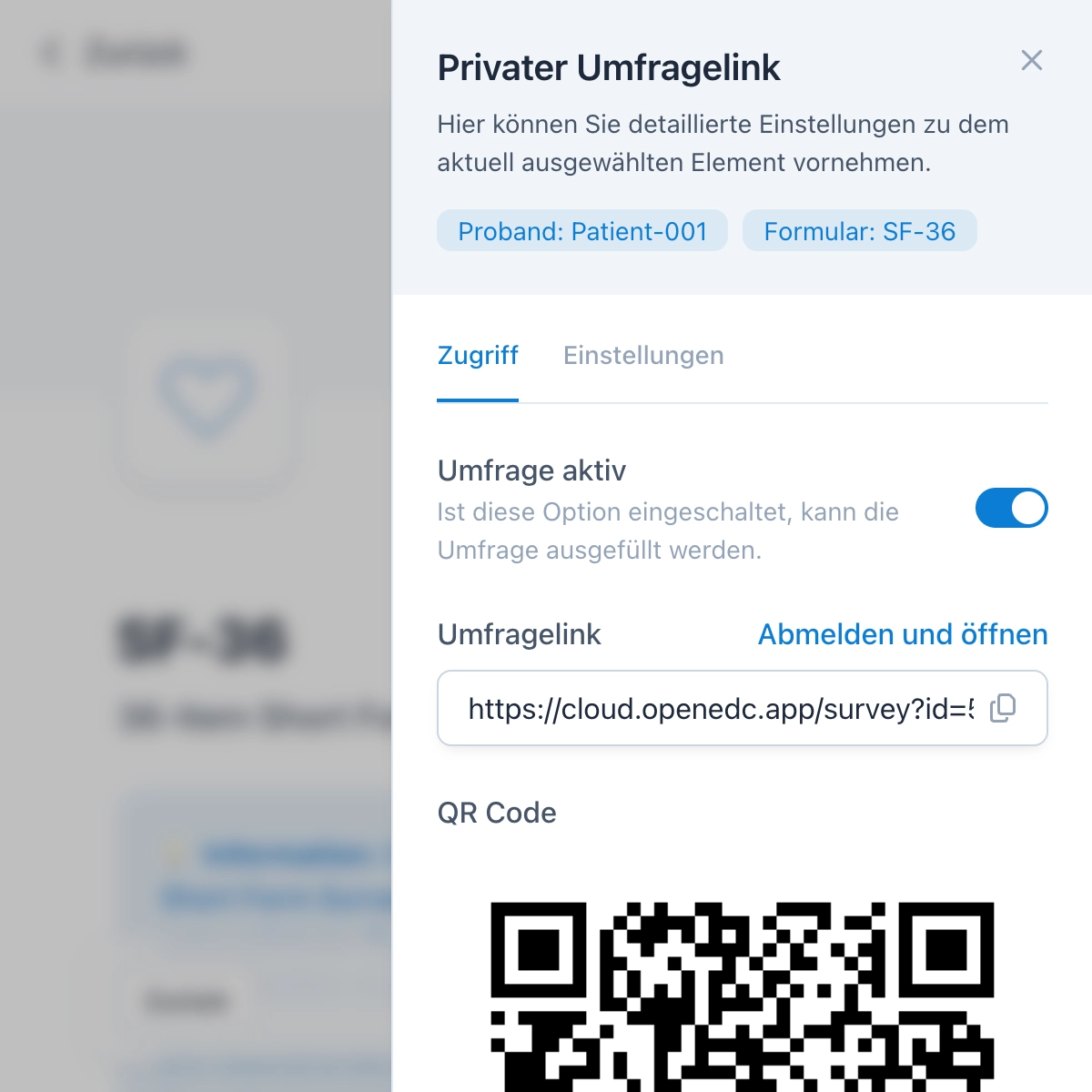
Umfragen für ePRO und eCOA
Umfragen können Sie als Link oder QR-Code im Handumdrehen verschicken und so elektronische Patient-Reported Outcomes (ePROs oder eCOA) erheben. Zusätzlich können Sie Teilnehmenden die Möglichkeit geben, sich für die Studie zu registrieren, um eine eigene Probanden-App für zukünftige Visiten zu verwenden.
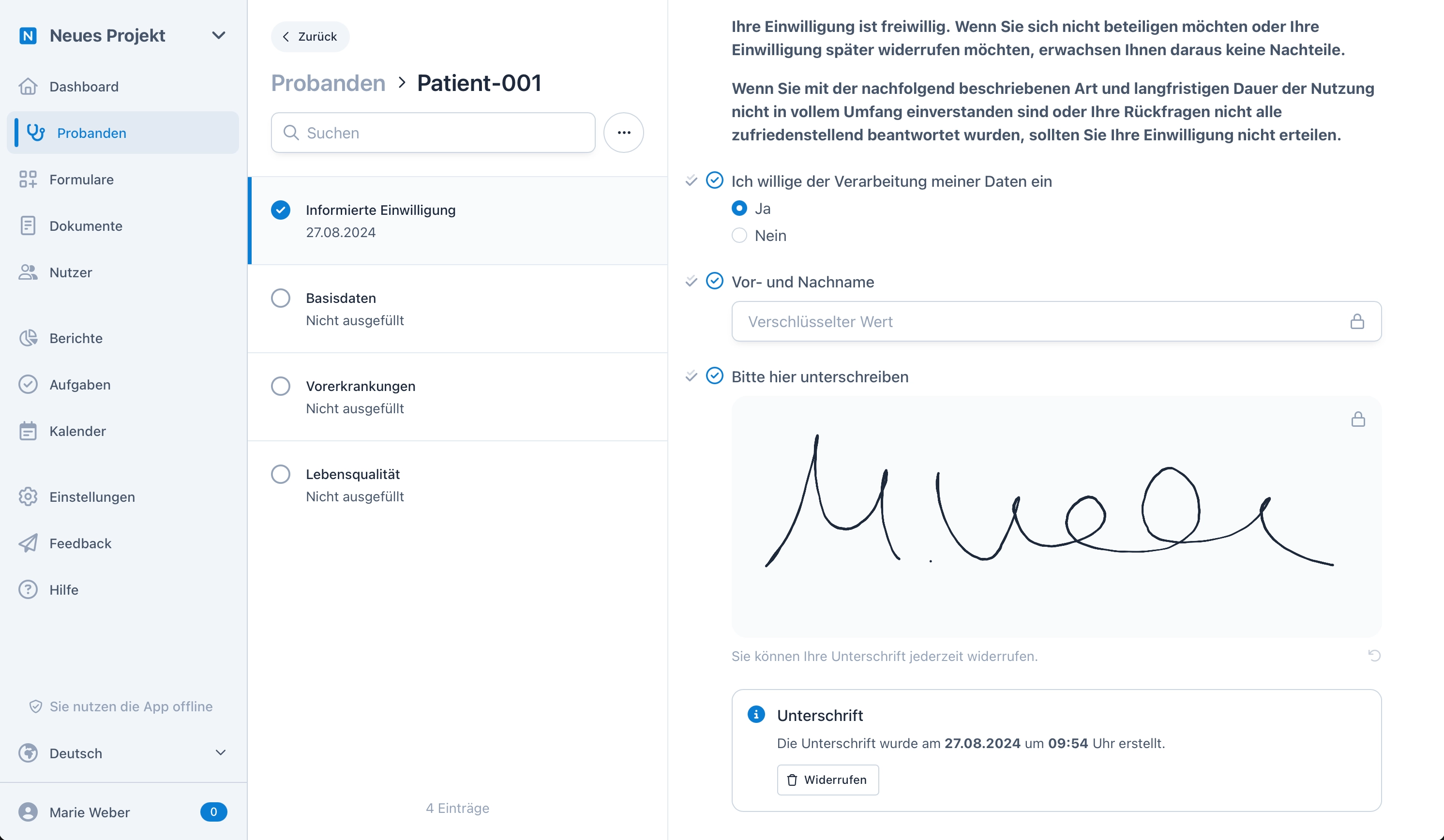
Identifizierende Daten. Verschlüsselt.
OpenEDC ist das erste EDC System, welches eine Ende-zu-Ende-Verschlüsselung für identifizierende Daten anbietet. Speichern Sie zum Beispiel den Namen eines Probanden in der Informierten Einwilligung bzw. dem eConsent so, dass nur Sie und der Proband ihn lesen kann – selbst wir haben keine Möglichkeit diese Daten zu entschlüsseln. Das funktioniert auch biometrisch per Fingerabdruck, Face-ID oder Windows Hello.
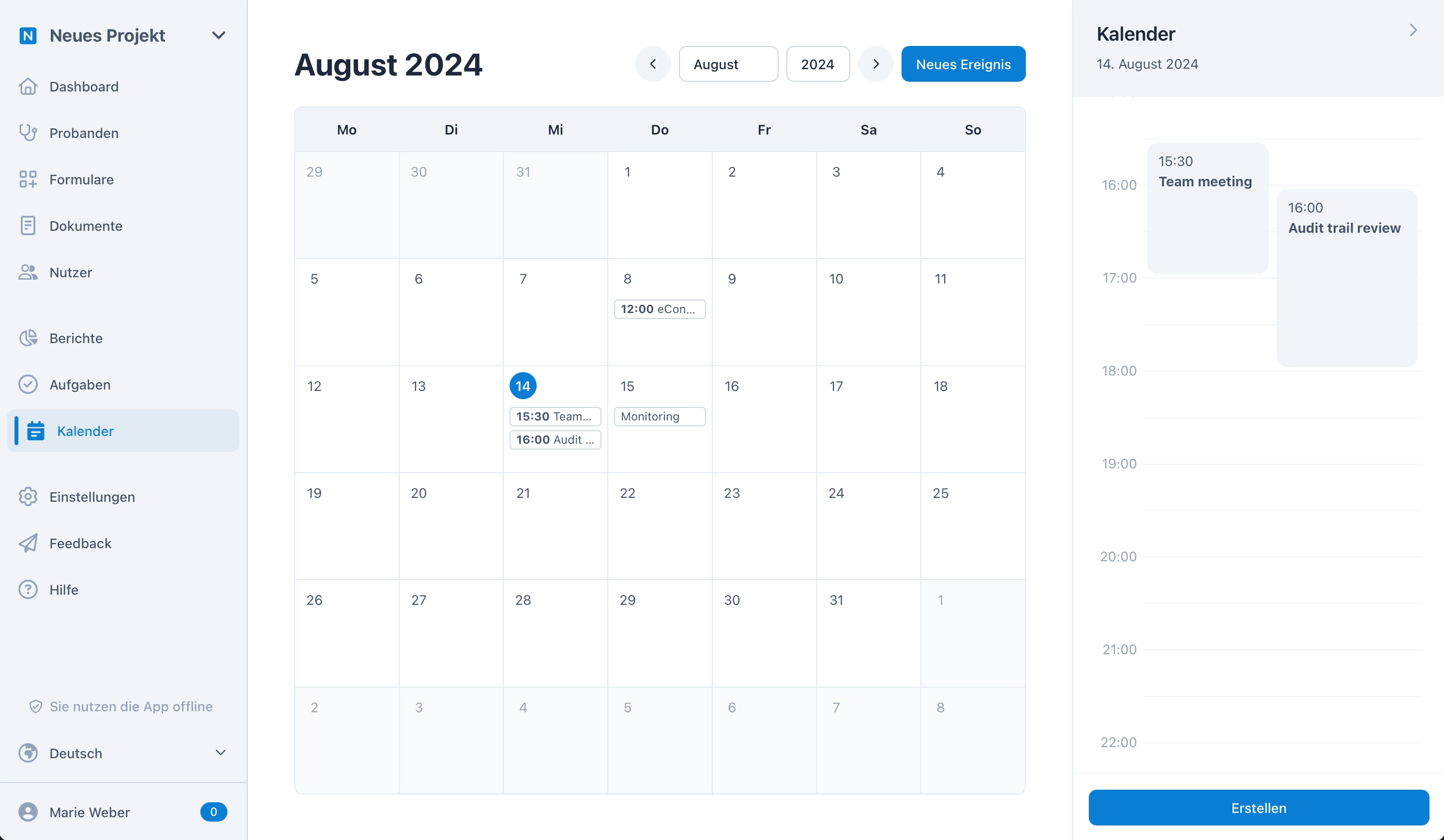
Kalender und Visiten
Mit dem Kalendermodul kann jeder aus Ihrem Team geteilte oder individuelle Termine erstellen und verwalten. So bleiben alle immer auf dem neusten Stand. In longitudinalen Studien werden die nächsten Visiten für jeden Probanden automatisch im Kalender angezeigt – dies ermöglicht eine zentrale und effiziente Organisation, ganz ohne manuelle Terminplanung.
Weitere Funktionen
OpenEDC bietet viele weitere Funktionen, die bei jeder Studie helfen.
-
Pseudonymisierung
- Verwaltung von Teilnehmenden einer Studie – bei Bedarf auch vollständig pseudonymisiert.
-
Randomisierung
- Verschiedene Verfahren zur automatischen Randomisierung von Probanden.
-
Dokumentenverwaltung
- Revisionssichere Dokumente für Patienteneinwilligungen, SOPs, Wikis oder ähnliches.
-
Multizentrische Studien
- Verwaltung von mehreren Standorten für verteilte, multizentrische Studien.
-
Events und Visiten
- Gruppierung von Formularen für longitudinale Studien und Forschungsprojekte.
-
Wiederholbare Daten
- Patiententagebücher oder Medikamentionslisten mit beliebigen Wiederholungen.
-
Excel und CSV Import
- Bestehende Daten können bereinigt, standardisiert und importiert werden.
-
Änderungsgrund
- Angabe eines Grunds bei Änderungen von Daten – gemäß GCP-Verordnung.
-
Query Management
- Stellen Sie Rückfragen zu einzelnen Datenpunkten und verfolgen Sie deren Status.
-
Source Data Verification
- Überprüfung der Übereinstimmung von erfassten Daten mit Quelldokumenten.
-
Digitale Unterschriften
- Kryptografische elektronische Signaturen nach erneutem Login für GCP-Konformität.
-
Zwei-Faktor-Authentifizierung
- Erhöhte Sicherheit durch zusätzliche Authentifizierung mittels Einmalpasswort.
Referenzen
Erfahrungen aus der Praxis
OpenEDC wird bereits in mehreren großen Projekten und Einrichtungen eingesetzt. Dazu gehören innovative Vorhaben mit hohen Anforderungen an Modularität und Standardisierung.

“Für das vom Gemeinsamen Bundesausschuss (G-BA) geförderte Projekt EXPERT benötigen wir ein System, um longitudinale Verlaufsdaten zu erheben und somit die Effektivität unserer Therapieempfehlungen zu evaluieren. OpenEDC erfüllt alle unsere Anforderungen und ist von allen Mitarbeitenden intuitiv, schnell und fehlerfrei zu bedienen.”

“Die großen Vorteile von OpenEDC sind für uns die Nutzerfreundlichkeit, Erweiterbarkeit und Interoperabilität. Durch die Unterstützung des Datenstandards CDISC ODM können wir sowohl Metadaten als auch klinische Daten in einem anerkannten Format exportieren, importieren und somit für zukünftige Studien sowie Auswertungen wiederverwenden.”

“Die dezentrale Datenhaltung und Pseudonymisierung bzw. Record-Linkage ist ein entscheidender Faktor für uns. Wir können damit föderierte Verbundprojekte realisieren, ohne die Bedürfnisse der teilnehmenden Kliniken außer Acht zu lassen. Jede Klinik behält die Kontrolle über ihre Daten – und trotzdem ist ein übergreifendes Monitoring mit OpenEDC möglich.”
Kontakt aufnehmen
Sie möchten Ihre Studie einfach, sicher und kosteneffizient durchführen? Dann melden Sie sich gerne und wir stellen Ihnen OpenEDC Health vor.



